作者:盛经纬1 高家红1,2,3,†
(1 北京大学前沿交叉学科研究院磁共振成像研究中心)
(2 北京大学物理学院医学物理和工程北京市重点实验室)
(3 北京大学IDG麦戈文脑科学研究所)
本文选自《物理》2021年第7期
摘要 脑磁图仪通过记录大脑神经活动在头皮外产生的磁场来进行脑活动的成像,它具备超高的时间分辨率和较高的空间分辨率,是一种重要的无创脑功能成像技术。文章介绍了脑磁信号的神经生理起源、生物物理特征及其与脑电信号的联系和区别,回顾了当前基于超导量子干涉仪的脑磁图设备与相关技术,并针对制约当前超导脑磁图发展的技术瓶颈,介绍了基于原子磁强计的新型脑磁探测技术及国内相关研究的最新进展,指出了脑磁图在脑科学研究及临床应用中不可或缺的地位和其硬件技术未来发展的方向。
关键词 脑磁图,超导量子干涉仪,原子磁强计,脑功能成像
1 引 言
电与磁作为一对“孪生兄弟”,是物理学和谐之美的典型体现。早在19世纪初,丹麦物理学家奥斯特(Oersted)就发现了电流产生磁场这一现象[1],打破了早期电与磁之间被孤立研究的屏障。麦克斯韦方程组则全面地揭示了电场与磁场之间的转换关系,构成了现代社会不可或缺的电磁理论基础。
在生命科学中,电与磁作为一组深度耦合的信号,携带了大量生命体活动的信息,并且在一定程度上具有互补性。以人类最复杂的器官——大脑为典型代表,其内部神经元之间最重要的通讯载体就是电流。为获得精准的神经活动信息,神经电生理学研究和临床脑外科通过将电极直接植入脑组织中进行电信号记录,但是这样的探测方式对一般人来说创伤是极大的,且能够覆盖的大脑区域也非常受限。脑电图(EEG)也称头皮脑电图,通过记录头皮上的电势变化和分布来观测脑活动。德国神经外科医生伯格(Berger)于1929年报道了世界上首次记录到的人类大脑头皮上神经元自发放电信号[2]。作为当前最常见的一种无创伤脑神经电信号探测手段,脑电图已经在临床上被广泛应用于睡眠、癫痫及其他脑神经系统疾病的评估中。然而,在头皮和大脑组织之间起保护作用的颅骨电导率远小于其他周围组织,极大地降低了颅外探测脑电的信号强度;另外,电导率的巨大改变也使得头皮电势的分布受到严重的扭曲变形。因此,尽管成本较低、实施简便,脑电图一般被认为是信号有畸变、空间分辨受限的脑成像方式,多作为神经科学基础研究的一种成像模态和临床配合其他设备辅助诊断的工具。
大脑内神经电流的传播将产生磁场,而包括颅骨在内的不同脑组织的磁导率几乎是相同的,也就是说大脑对于磁场的传播来说基本上是“透明”的[3],这为脑神经磁场的探测提供了一个强大的驱动力:获得近乎无损的脑实时神经活动信号。然而,如此理想的神经磁信号探测是十分困难的,图1给出了脑神经磁场与其他生物磁场及典型生活环境磁场的大小对比,典型的脑磁场在头皮外的强度介于10—100 fT(1 fT=10-15 T)量级,约为地球磁场的亿分之一。如何在相对巨大的地球磁场本底背景和剧烈波动的外界电磁波动态干扰下实现极弱脑磁信号的探测,在物理原理和技术上给人类提出了巨大的挑战。
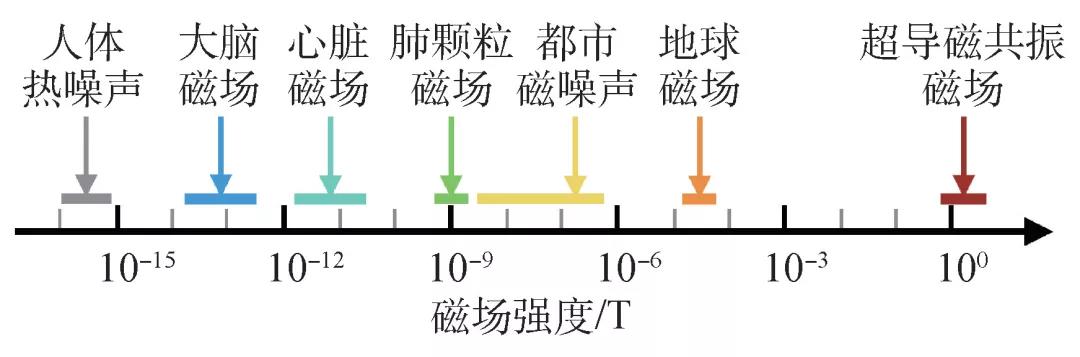
图1 头皮外脑磁场与其他生物磁场及生活常见磁场幅度对比
本文将从脑电磁信号产生的神经机理和生物物理出发,首先介绍脑磁图(MEG)的传统探测技术和发展历程,然后描述当前有望给脑磁探测带来革命性变化的新型原子磁强计技术及国内相关研究的进展,最后展望脑磁图仪未来在神经科学和临床医学上的应用前景。
2 神经电场与磁场
2.1 神经电磁信号的神经生理起源
神经元在兴奋时,通过膜内外离子通道的开闭产生随时间变化的电流。神经元主要有两种兴奋类型,一种是在神经元轴突上产生的快速去极化,相应神经电生理记录到的细胞膜内外电位变化被称为动作电位;第二种是神经元突触之间被神经受体调控发生在突触后神经元细胞膜上的电位变化,即突触后电位。一般情况下,通过神经电生理手段记录到的单个神经元兴奋产生的电位变化在几十毫伏水平,其产生的微弱电流或磁场几乎不可能在头皮上被观测到。因此,形成一个脑电图或脑磁图可观测的信号需要大量神经元放电的叠加。虽然就单个神经元兴奋电位记录来看,动作电位的幅度大于突触后电位,然而,动作电位的持续时间非常短,大约1—2 ms,即使是多个神经元放电,其宏观效果也是产生脉冲式的交替,很难形成幅度上的堆叠积分;突触后电位则相对缓慢,大约持续十毫秒以上,给多个神经元活动强度的叠加提供了可能。基于神经计算模型和经验数据,一个神经元兴奋产生的电流可等效为一个电流偶极子,强度多在1 pAm以下,大约10000—50000个排列一致的神经元几乎同时放电才能产生一个宏观上可以观测到的电磁信号[4]。人类大脑皮层中,每平方毫米有大约100000个神经元椎体细胞,平均每个神经元有上千个突触,同时在新皮层中多数神经元是垂直于皮层表面的,在局部具有较一致的方向性,这构成了宏观可观测的脑电磁信号生理基础[5]。
2.2 脑电图与脑磁图的异同
尽管信号来源相同,脑电和脑磁在信号构成和特征上还有着显著的区别。由于电流与其产生的磁场之间方向遵循“右手螺旋定则”,如果把大脑比作一个球体,沿着径向垂直于头皮的电流产生的磁场将无法传播到大脑头皮外,因而脑磁图的信号主要来源于脑沟回中的神经元放电[5—7];与此不同的是,脑电图对径向电流更敏感,同时也可以采集其他方向的电流信号(图2(a))。从宏观头皮外探测到的电信号与磁信号分布来看,同样脑活动下产生的电流,在脑电图和脑磁图的二维插值的地形图上则呈现出“正交”的信号分布关系(图2(b))[6]。因此,在科学研究和临床应用上,也可将脑磁图与脑电图进行同步采集,以获得更全面的脑神经活动信息[8]。
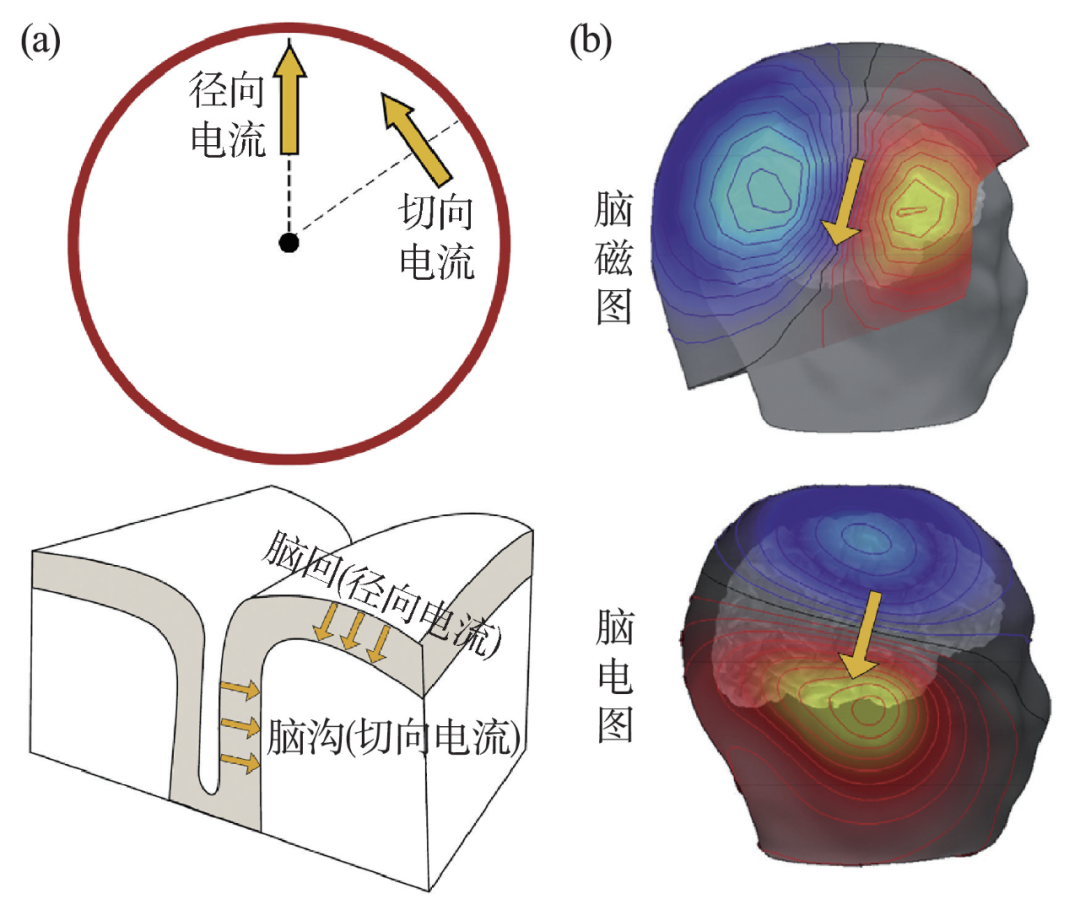
图2 (a)大脑中两种典型的电流方向和相应脑部沟回位置;(b)脑磁图与脑电图在头皮外信号分布形式的差异[6]
3 传统脑磁场测量技术与发展
人类历史上第一次脑磁信号的成功探测可以追溯到1968年,美国物理学家科恩(Cohen)使用多次平均的方法利用多匝感应线圈在特殊建造的磁屏蔽室内探测到了人类大脑阿尔法波(alpha rhythm)信号[9],但是这样的探测技术手段信噪比过低以至于无法在实际生活中使用。1972年,科恩进一步改进了技术手段,采用拥有磁探测高灵敏度特点的约瑟夫森结超导量子干涉仪(SQUID)技术[10],成功高效地探测到了脑磁信号[11],标志着现代脑磁图仪的开端。商业化的脑磁图仪从20世纪80年代出现,从最开始的单通道发展成了200—300通道覆盖全脑尺度范围的成熟系统。
图3(a)是在脑磁图仪中广泛使用的直流SQUID(DC-SQUID)示意图[5,7]。当施加的偏置电流IB分流到两条支路的电流略小于约瑟夫森结隧穿效应的临界电流时,电路保持在超导状态,两端的输出电压为零。当微小的磁场扰动Ba导致超导回路中的磁通量Φa发生变化从而出现感应电流时,电路中对称的电流分布将被打破,其中一个约瑟夫森结的电流将超过临界电流从而失去超导状态,此时电路两端将产生明显的电压下降。通过对输出电压的放大和闭环反馈,就形成了有效的磁场—电压线性转换,从而实现高灵敏的磁场测量。
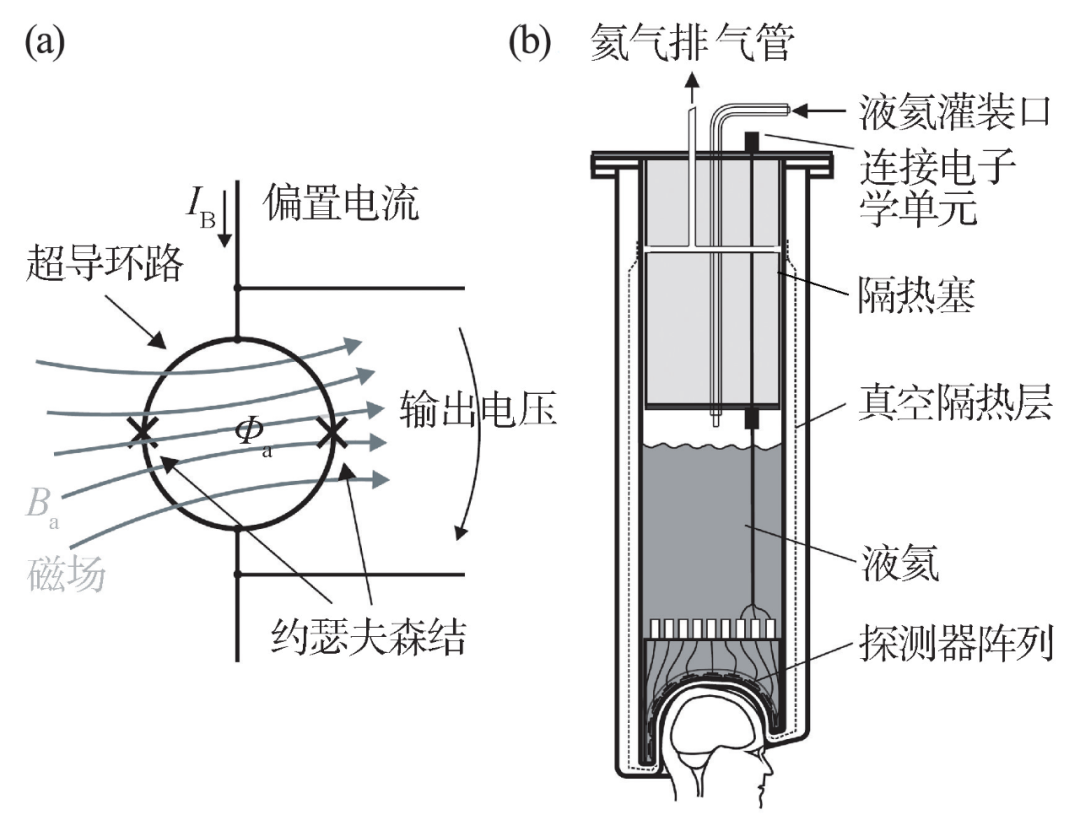
图3 (a)超导量子干涉仪原理示意图;(b)典型脑磁图所配备的杜瓦装置截面示意图[7]
在实验室理想条件下,SQUID的极限灵敏度约为1 fT/ ,目前商业化的实用脑磁图SQUID探测器灵敏度通常为2—3 fT/
,目前商业化的实用脑磁图SQUID探测器灵敏度通常为2—3 fT/ 。为了保持系统器件的超导工作状态,脑磁图仪需要杜瓦(Dewar)装置来盛放液氦并保持系统内部超低温隔热环境。图3(b)显示了脑磁图系统中使用的典型杜瓦装置截面,一套覆盖全脑的脑磁图系统一天将消耗10—20 L液氦,而脑磁图杜瓦腔内一般能容纳70—90 L液氦,这导致超导脑磁图仪每周需要1—2次液氦补充来保持系统的正常运行,一次补充过程还将消耗大约10 L的液氦,且SQUID探测系统在液氦补充完成后需要等待几个小时才能达到稳定可使用状态。同时,为了在室温运作条件下保持系统内部的超低温,杜瓦装置的最外层被抽成真空以达到理想的隔热效果。一般杜瓦隔热真空层的厚度约为3 cm,也就是超导探测器与头皮之间还存在着磁场信号衰减的一段距离。此外,刚性的杜瓦装置头盔约束了探测器空间排布形式,绝大多数脑磁图仪只能采用一个头盔阵列匹配所有的受试者,头盔与个体头部轮廓的不匹配进一步拉开了探测器与头皮的距离,在儿童等群体中的影响尤为严重。
。为了保持系统器件的超导工作状态,脑磁图仪需要杜瓦(Dewar)装置来盛放液氦并保持系统内部超低温隔热环境。图3(b)显示了脑磁图系统中使用的典型杜瓦装置截面,一套覆盖全脑的脑磁图系统一天将消耗10—20 L液氦,而脑磁图杜瓦腔内一般能容纳70—90 L液氦,这导致超导脑磁图仪每周需要1—2次液氦补充来保持系统的正常运行,一次补充过程还将消耗大约10 L的液氦,且SQUID探测系统在液氦补充完成后需要等待几个小时才能达到稳定可使用状态。同时,为了在室温运作条件下保持系统内部的超低温,杜瓦装置的最外层被抽成真空以达到理想的隔热效果。一般杜瓦隔热真空层的厚度约为3 cm,也就是超导探测器与头皮之间还存在着磁场信号衰减的一段距离。此外,刚性的杜瓦装置头盔约束了探测器空间排布形式,绝大多数脑磁图仪只能采用一个头盔阵列匹配所有的受试者,头盔与个体头部轮廓的不匹配进一步拉开了探测器与头皮的距离,在儿童等群体中的影响尤为严重。
高灵敏度磁探测器需要工作在相对低的磁本底环境中,磁屏蔽系统也是脑磁图仪不可或缺的重要组成部分。鉴于外界磁场与脑磁信号幅度的巨大差异,最直接降低干扰的方式是将脑磁探测设备和被测试人员放置在一个封闭的磁屏蔽室(MSR)内进行数据采集。商业脑磁图仪的磁屏蔽室多由两层或三层高导磁合金配合高导电合金拼接而成,其边长约2—4 m,使用铝合金作为骨架搭建。铝、铜合金等高导电材料利用涡流屏蔽高频磁场和电磁波,而决定中低频磁屏蔽性能的最关键部分是高导磁材料,其构成多为铁镍合金配合一些其他元素,国内的坡莫合金和国外的μ合金均为此类材料。高导磁合金主要作用方式是将磁场扭曲,将磁通吸引入合金内,从而降低低频磁场对磁屏蔽室内部空间的影响。高导磁合金层数越多,磁屏蔽室具有越突出的磁屏蔽性能,但是相应的成本也越高,磁屏蔽室的重量也会随之大幅度增加。
除了被动工作的磁屏蔽室外,脑磁图仪还应用了一些其他手段抑制噪声。主动补偿线圈依靠产生与外界干扰相抵消的磁场,一般会与磁屏蔽室结合使用。另外,SQUID还可以构成梯度计,通过差分的方式获得对环境波动更不敏感的有效磁场信号。最后,在软件和算法层面,脑磁图仪通过参考通道、信号空间投影[12]、信号空间分离[13]等方式,从多通道阵列的角度对噪声进行进一步的抑制。
由于脑磁图只能获得神经功能活动信号而无法获得脑结构信息,因此在脑磁图诊断和源定位时通常还需要借助磁共振成像设备获得重建的三维头部解剖图像。在脑磁图数据采集前会使用三维空间标定装置记录个体的头部轮廓信息并与脑磁探测器阵列进行配准,之后再通过空间刚体转换的方式与磁共振大脑结构图像完成空间坐标的融合,从而得到每一个探测器相对脑组织的相对位置关系。脑磁图的源定位与脑电图一样,从理论上来说是一个没有唯一解的病态问题,因此,在脑磁图反演求逆问题计算中需要引入一些额外的数学约束或假设。最早应用在脑磁图定位中的算法是等效偶极子(ECD)模型,即将全脑的活动等效为一个或为数不多的几个电流偶极子进行约束求解,这样的方式至今还在临床尤其癫痫病灶定位上广泛使用,但是对于多源和分布式脑活动等大多数实际脑认知活动和神经系统疾病情况,该方法容易出现较大偏差。后期发展的脑磁图源成像方法是将大脑空间离散化为成千上万个格点,每一个格点用一个等效偶极子来设定。这样的情况下则出现了未知数(即格点数)远大于方程数(即探测器数)的欠定方程求解问题。添加一些额外的约束条件是解决该问题的有效途径,脑磁图源定位常用的约束条件有最小模估计(MNE)[14]和波束形成法(Beam former)[15]等多种方法。当前,基于最小1范数、最小1范数与最小2范数混合约束的方法能够有效平衡源定位空间分辨率和求解的弥散度[16,17],已被应用到精细的脑神经加工定位反演中[18],并在临床上得到了结果较一致的验证[19]。
4 新型原子磁强计脑磁测量技术
尽管超导脑磁图仪已经形成了商业化产品,但是该设备昂贵的造价和维护成本、较大信号衰减距离以及庞大的系统空间体积,严重地制约了其推广普及。当前全世界脑磁图装机量约两百余台,国内累计装机量仅十余台。物理学界一直在寻找不依赖于低温超导制冷且具备更高灵敏度和小型化集成的易于推广使用的新型脑磁探测技术。
原子磁强计(也称光泵磁强计,即OPM、原子磁力计、原子磁力仪)是利用光与原子的相互作用来探测磁场的技术,原理与超导量子干涉仪完全不同。原子磁强计可以在室温下工作、不需要液氦等制冷剂,是替代传统超导器件进行脑磁探测的最佳选择。图4是一个典型的原子磁强计工作原理示意图[20],对碱金属原子(一般为K,Rb,Cs)施加一束波长对应其激发态能谱线的圆偏振光,原子吸收能量产生能级跃迁,由于光抽运原理而最终大量聚集在一个超精细能级从而实现很高的极化率,该圆偏振光被称为泵浦光。当极化的原子自旋周围存在一个很小的磁场时,原子会在外磁场下做拉莫尔进动而产生一个进动偏角,该进动偏角的大小在一定范围内与磁场强度成正比。此时,用另外一束与泵浦光垂直的线偏振光经过原子自旋系统时,由于光与进动原子的相互作用,其偏振方向会发生微小偏转,通过探测偏振角的变化可以直接反应磁场的大小。原子磁强计的具体实现形式非常多样,如使用单束调制的光来同时实现原子自旋系统的泵浦和检测,此处不再一一列举。早期的原子磁强计灵敏度受诸多因素制约,导致其灵敏度远不如超导量子干涉仪,其中一个最主要的因素就是原子自旋之间的交换弛豫效应导致系统快速去极化降低了自旋系统的极化率。20世纪初,物理学家针对这一限制发展了基于无自旋交换弛豫(SERF)理论[21],通过提高原子数目密度和降低环境磁场的方式从宏观上有效地压制了自旋交换弛豫效应,实现了原子磁强计灵敏度的突破。当前实验室下无自旋交换弛豫原子磁强计装置能够取得0.16 fT/ 的灵敏度[22],是人类目前掌握的最灵敏磁探测物理技术,其理论计算的灵敏度可达0.01 fT/
的灵敏度[22],是人类目前掌握的最灵敏磁探测物理技术,其理论计算的灵敏度可达0.01 fT/ 甚至更低[23]。更重要的是,原子磁强计具备小型化集成的条件,当前小型化的原子磁强计横截面边长可缩小至1—2 cm,灵敏度可达10—20 fT/
甚至更低[23]。更重要的是,原子磁强计具备小型化集成的条件,当前小型化的原子磁强计横截面边长可缩小至1—2 cm,灵敏度可达10—20 fT/ [24],并随着工艺和操控手段的优化不断向实验室极限水平逼近。
[24],并随着工艺和操控手段的优化不断向实验室极限水平逼近。
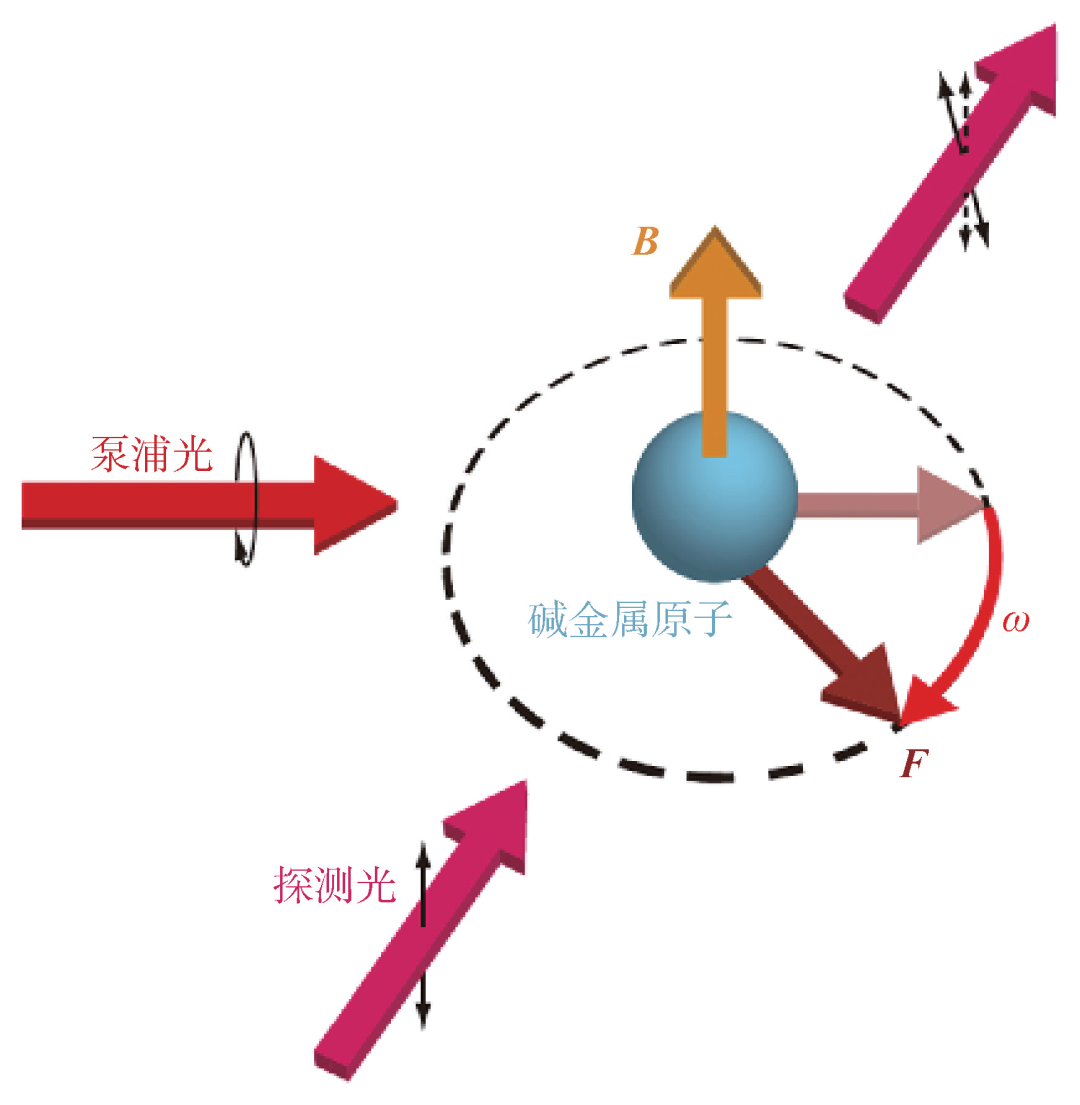
图4 一种典型的原子磁强计工作原理示意图[20]
由于原子磁强计的工作不需要液氦维持,基于该技术的新型脑磁图装置也将不再受庞大的杜瓦装置制约而变得灵活高效且成本降低,有效地解决了当前超导脑磁图仪存在的问题。图5(a)给出了实验重建出的超导脑磁图探测器阵列和原子磁强计脑磁图探测阵列与头皮的位置关系图,不再有真空隔热层的距离限制后,原子磁强计几乎可以紧贴头皮并适应个体的头部轮廓,这使探测器得到的脑磁信号绝对强度有大幅度的提升,该优势已经在多个实验中被证实[25,26](图5(b))。原子磁强计的灵活性给穿戴式脑磁图仪提供了可能,诺丁汉大学研究组率先在增加了主动补偿线圈的磁屏蔽室中实现了可穿戴的脑磁信号记录,被测试人员可以在脑磁信号采集的过程中端起杯子喝水甚至完成颠乒乓球等动作[27],该研究组还将系统推广到不同年龄阶段的人群[28],实现了脑磁图仪工作方式的跃变。
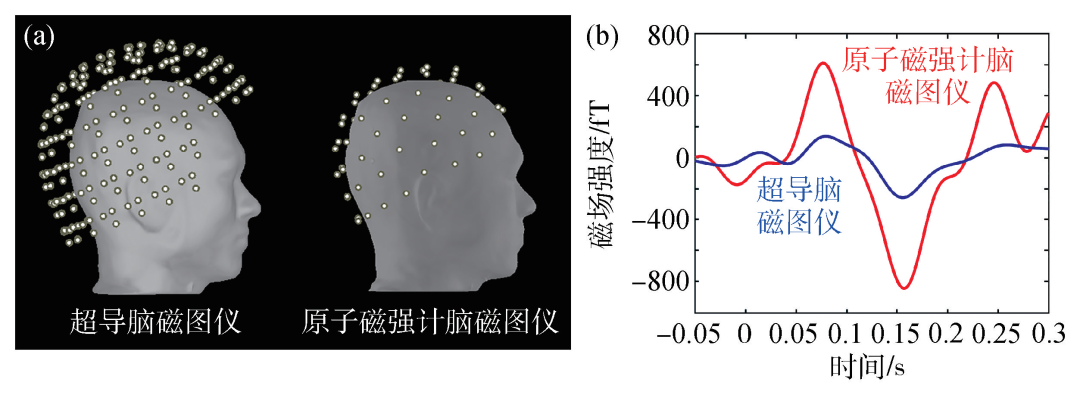
图5 (a)基于原子磁强计的新型脑磁图与超导脑磁图探测器阵列与头皮的空间位置关系对比;(b)实验获得的典型基于原子磁强计的新型脑磁图与传统超导脑磁图在相同条件下的信号幅度对比[26]
北京大学医学物理和工程北京市重点实验室与合作单位于国内率先自主研制和开发了无自旋交换弛豫原理的小型化原子磁强计原型机并用于单通道脑磁信号探测与验证[26],对比于国外主流技术,该小型化探测器具有纯光学探测、无多通道串扰的潜在优势。当前,北京大学团队最新的小型原子磁强计探测器横截面积仅3 cm2,且已经具备了多通道集成的能力。同时,针对新型脑磁探测器的工作形式变化,该团队还开发了卧式的磁屏蔽装置以取代传统超导脑磁图庞大的磁屏蔽室[29],该装置可大幅度削减磁屏蔽室的建造与材料成本并提高临床装机的便捷度。此外,为配合多通道原子磁强计可适应被测试者个体化头部轮廓排布以完成高效脑磁信号探测的特点,团队还开发了基于光学扫描同步获取探测器空间位置及脸部轮廓信息并与磁共振结构图像进行一键式配准的新技术[30],解决了新型脑磁图在源定位前必要的空间配准过程耗时长和精度低的问题。北京大学医学物理团队已经完成了具有自主知识产权的新型原子磁强计脑磁图原理样机开发,当前的脑磁图系统具备32通道,可以实现覆盖一片脑区的脑磁信号探测与源定位(图6(a))。系统样机已经在脑磁图经典的听觉诱发实验中得到验证,成功定位到了个体单侧初级听觉皮层激活区域(图6(b))。
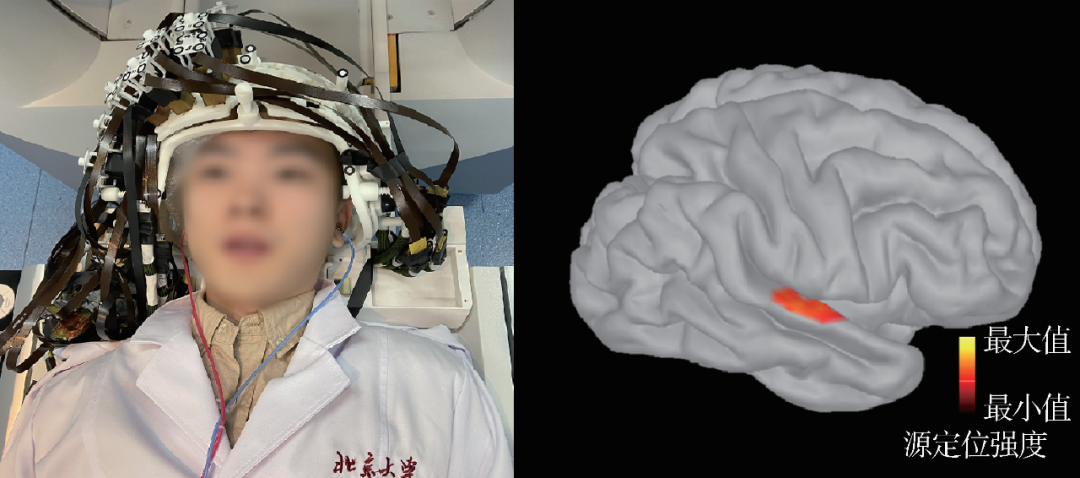
图6 国内基于原子磁强计新型脑磁图的进展 (a)原子磁强计脑磁图探测器阵列与采集场景;(b)原子磁强计脑磁图定位到的听觉诱发的初级听觉皮层区域
兼具小型化与高灵敏度的原子磁强计及相关技术目前正处于迅速发展时期,在合理解决和平衡多通道信号串扰、响应带宽、高温原子气室隔热、梯度计等面向可推广式脑磁信号采集与成像的问题后,国内外有望发展出成熟的、基于原子磁强计的新型脑磁图仪。
5 总结与展望
脑磁图仪作为兼具高时间分辨率和高空间分辨率的脑功能成像模态,是目前能够无创伤地获得全脑尺度下神经实时活动的理想技术。脑磁图与脑电图虽同源但有着显著的区别,在50余年来基于超导磁探测技术的系统发展中,脑磁图已经成为解析大脑功能不可或缺的研究工具,并在临床如癫痫、自闭症等神经系统疾病的诊断中展现出了独特的应用价值[31,32]。当前以原子磁强计为代表的新型磁探测技术有望弥补超导技术的不足,构建新型脑磁图仪,以获得更清晰的脑活动信号和更灵活的探测与应用方式,显著拓展脑磁图的应用范围并降低设备装机门槛,在脑科学研究和脑疾病诊疗中发挥更大的作用。
致 谢 感谢课题组李东旭、崔云扬、茹星语和覃朗对本文细致的阅读建议和相关图片的协助整理。
[1] Oersted H C. Ann. Philos.,1820,16(4):273
[2] Berger H. Arch. Psychiatr. Nervenkr.,1929,87(1):527
[3] Okada Y C,Lahteenmäki A,Xu C. Clin. Neurophysiol.,1999,110(2):230
[4] Murakami S,Okada Y. J. Physiol.,2006,575(3):925
[5] Hämäläinen M,Hari R,Ilmoniemi R J et al. Rev. Mod. Phys.,1993,65(2):413
[6] Hari R,Baillet S,Barnes G et al. Clin. Neurophysiol.,2018,129(8):1720
[7] Hansen P,Kringelbach M,Salmelin R(Eds.). MEG:An Introduction to Methods. Oxford Univ. Press,2010
[8] Baillet S. Nat. Neurosci.,2017,20(3):327
[9] Cohen D. Science,1968,161(3843):784
[10] Zimmerman J E,Thiene P,Harding J T. J. Appl. Phys.,1970,41(4):1572
[11] Cohen D. Science,1972,175(4022):664
[12] Tesche C D,Uusitalo M A,Ilmoniemi R J et al. Electroencephalogr. Clin. Neurophysiol.,1995,95(3):189
[13] Taulu S,Simola J,Kajola M. Neurol. Clin. Neurophysiol.,2004,2004:35
[14] Hämäläinen M S,Ilmoniemi R J. Med. Biol. Eng. Comput,1994,32(1):35
[15] Van Veen B D,Buckley K M. IEEE ASSP Mag.,1988,5(2):4
[16] Gramfort A,Strohmeier D,Haueisen J et al. NeuroImage,2013,70:410
[17] Huang M X,Huang C W,Robb Aet al. NeuroImage,2014 84:585
[18] Sheng J,Zheng L,Lyu B et al. Cereb. Cortex,2019,29(8):3232
[19] Zheng L,Sheng J,Cen Z et al. IEEE Trans. Biomed. Eng.,2021,68(3):793
[20] Seltzer S J. Developments in alkali-metal atomic magnetometry. Princeton University,2008
[21] Happer W,Tang H. Phys. Rev. Lett.,1973,31(5):273
[22] Dang H B,Maloof A C,Romalis M V. Appl. Phys. Lett.,2010,97(15):151110.
[23] Kominis I K,Kornack T W,Allred J C et al. Nature,2003,422(6932):596
[24] Osborne J,Orton J,Alem O et al. Fully integrated standalone zero field optically pumped magnetometer for biomagnetism. In:Steep Disper. Eng. Opto-Atom. Prec. Metrol.,XI,2018,10548:105481G
[25] Boto E,Meyer S S,Shah V et al. NeuroImage,2017,149:404
[26] Sheng J,Wan S,Sun Y et al. Rev. Sci. Instrum.,2017,88(9):09430
4[27] Boto E,Holmes N,Leggett J et al. Nature,2018,555(7698):657
[28] Hill R M,Boto E,Holmes N et al. Nat. Commun.,2019,10(1):1
[29] He K,Wan S,Sheng J et al. Rev. Sci. Instrum.,2019,90(6):064102
[30] Gu W,Ru X,Li D et al. J. Neurosci. Methods,2021,358:109181
[31] Plummer C,Vogrin S J,Woods W P et al. Brain,2019,142(4):932
[32] Roberts T P L,Khan S Y,Rey M et al. Autism Res.,2010,3(1):8



 微信公众号
微信公众号
 下载app
下载app
 京公网安备 11010202008974号
京公网安备 11010202008974号