来源:iPlants
摘要
菌根是最重要的生物界间相互作用之一,因为它们涉及约34万种陆地植物和约5万种土壤真菌。在这些互惠互利的相互作用中,真菌接受光合作用产生的碳,并为寄主植物提供磷和氮等矿物质营养作为交换。150多年来,对菌根的研究提高了人们对其生物学、生物多样性和生态影响的认识。本文系统综述了基于基因组学、分子生物学和细胞生物学的相关研究进展,介绍了菌根真菌的起源及其与陆生植物共生关系的进化历史。由于菌根具有多种表型,且其表型主要取决于共生植物的分类、生理和细胞相互作用,我们还探讨了菌根类型之间的异同。在进化过程中,菌根真菌已经改进了它们的生物营养能力,以利用它们的寄主作为食物来源和防护生态位;而植物也已经发展了多种策略,以适应与不同真菌的共生。它们广泛的生态成功主要得益于这两种进化路径的交互作用。我们对这些共生生物背后的生物过程的理解,为设计生物技术应用来应对环境和农业挑战提供了工具,例如,真菌作为生物肥料和生物保护剂具有重要的应用前景。
前言
菌根是普遍存在于植物根系和土壤真菌之间的互惠共生体。通过这两个共生伙伴之间亲密的细胞接触,菌根真菌从进行光合作用的寄主那里获得固定的碳,以交换磷和氮等矿物质营养,这对植物生长有积极影响。共生对寄主植物的有益影响还包括提高了其对生物和非生物胁迫的耐受性。此外,菌根在自然和农业环境中提供多种生态系统服务。菌根真菌是土壤中碳封存和颗粒聚集的已知驱动者,对微生物和植物群落的组成有重大影响。基于这些原因,菌根被认为塑造了自植物陆地化以来的生物圈进化,并且在当前日益增长的环境关注的背景下,它们是生态系统功能的重要角色。
现存的维管和非维管植物可形成菌根,数量在32万至34万之间。其中,被子植物的菌根种类最多,最具多样性(约占85-90%)。它们包括树木、灌木、草本植物和大多数主食作物,如水稻、小麦、玉米、土豆、甘薯、西红柿和木薯。对于真菌伙伴来说,估计至少有50000种子囊菌、担子菌和毛霉菌组成了菌根。这种惊人的多样性,在植物和真菌超过4亿年的共同进化中得到了支持,已经产生了4种主要的菌根类型,它们出现在植物进化的不同时期,并具有特定的形态特征:丛枝菌根(AM)、外生菌根(ECM)、兰科菌根(ORM)和欧石楠类菌根(ERM;参见图1)。自20世纪80年代首次实现超微结构观察以来,每一种菌根类型(框 1)中细胞与细胞间相互作用使植物生物学家着迷,并为随后研究这些共生生物的信号传递和基因调控奠定了基础。

图1. 主要的菌根类型。a、外生菌根(ectomyrhizas, ECM)主要涉及树木和灌木,内生菌根(endomycoras,包括杜鹃花类菌根(局限于杜鹃花科),兰花菌根(ORM;局限于兰科)和更广泛的丛枝菌根(AM)。b、显示了互惠共生菌根中营养物质的相互交换。在AM中,植物通过光合作用固定的有机碳被转移到真菌体内,并从中交换土壤中的水分及其它含磷、氮、硫和其它必需营养素的无机化合物。c、一些真菌种类,如红菇科,发展了不同类型的菌根相互作用:ECM与树种,ORM与兰花。d、相反的情况是,一个单一的寄主(如杨树)可以同时发展AM和ECM。e、图中显示了植物群落中共同菌根网络的形成,真菌菌丝在这里定植并连接不同植物的根,从而实现了营养和信号的交换。
虽然大多数植物能够形成菌根,但菌根分布不均匀, AM是主要类型(72%),其次为ORM(10%)、ECM(2%)和ERM(1.4%)。多种菌根类型在许多生态系统中共存,植物和真菌物种在某些情况下建立了一种以上的菌根(图1)。此外,单个真菌可以侵染不同寄主植物,建立一个“共同的菌根网络”(图1);也就是连接不同植物个体的地下菌丝网。
菌根真菌现在被认为是植物微生物的主要组成部分,生物多样性与多细胞个体紧密联系的微生物群落生态系统,对人类的影响不亚于对植物健康的影响。在这种情况下,菌根真菌可以作为所谓微生物革命的驱动者;即开发可持续的、以微生物为基础的工具,以提高植物健康和生产力。
框1. 外生菌根、丛枝菌根、兰花菌根和石兰花菌根的主要细胞特征
大多数菌根相互作用属于图中所示的四种类型之一,这也是研究最多的。在丛枝菌根中,发源于土壤萌发孢子的菌丝通过一种被称为“菌丝足”的扁平分枝结构与寄主侧根的表皮细胞接触。胞壁和表皮细胞壁以一种不清楚的软化和交织的过程附着。然后渗透菌丝发育,穿过具有不同定植模式的外部根细胞层,包括形成松散的细胞内螺旋和分枝的菌丝,最后到达内部皮层细胞,在那里形成树状的树状芽胞。细胞内的菌丝和芽孢通常与植物的细胞质分离,由一个被真菌周膜(寄主原生质膜的特殊延伸)包围的载壳界面(绿色)。枝周界面被认为是营养交换的主要场所,可能是由管状扩张促进的,增加了交换表面。

在杜鹃花类菌根中,菌丝穿透杜鹃花科根的厚表皮细胞壁,不发育明显的粘附结构。然后在每个表皮细胞内产生密集的菌丝线圈,在这种情况下也被界面室(绿色)和延伸的植物膜所包围。
在兰花菌根中,共生真菌可在发芽的种子和幼苗的根中发展,但最能描述定植过程的是原球茎,即在种子萌发过程中形成的胚后结节状结构。在这种情况下,菌丝穿过表皮毛细胞,到达皮层薄壁组织,在一个膜界的共生界面内形成大的菌丝圈,称为“细气管球”。
在外生菌根中,新生侧根的根尖下表皮细胞是土传菌丝的目标。它们的增殖产生了一种被称为“覆盖物”的假实质组织,它吞噬了整个根底。这种独特的结构可能反映了这些真菌在其子实体中发展类似假组织的能力。外套膜的内部菌丝在表皮细胞之间进一步发育,到达皮层组织的不同深度(取决于寄主植物)。这种胞内菌丝从未穿过细胞腔,所谓的哈蒂氏网形成细胞间界面(绿色)。
本综述通过鉴定不同类型之间的独特和共同特征,来探讨菌根的生物多样性,这些菌根在历史上一直是根据它们的形态特征进行分组的(框 1)。化石数据和系统基因组学研究提供了一个基于进化的指导方针,说明古代腐殖真菌如何以腐烂的有机质为食,进化出一种基于生物营养的新的营养策略。此外,我们将讨论真菌的生物营养是如何被多种信号和定植过程所支持的,这是由植物中相对保守的遗传基础所支撑的。最后,我们概述了菌根共生作为全球情景中重要角色的潜力,该情景要求越来越多地使用可持续农业和环境战略(框2)。
框2. 菌根真菌的转化应用
在微生物群时代,菌根真菌已经被公认为是即将到来的微生物革命的潜在有益驱动者,与固氮细菌、其它植物生长促进微生物和内生菌一起。
由于菌根真菌的广泛多样化,已成功地应用于非常不同的领域。特别是,外生菌根(ECM)在森林管理方面具有巨大的潜力,包括在替代森林火灾后的再生和矿区的生态恢复。ECM真菌接种已用于针叶树和阔叶树的育苗。此外,越来越多的应用研究集中在ECM真菌上,这些真菌可以生产出全世界喜爱的美味食品,如牛肝菌、鸡油菌和松露。用黑松露(黑孢块菌)接种寄主树苗是如此成功,以至于80%以上的黑松露生产发生在法国的果园。
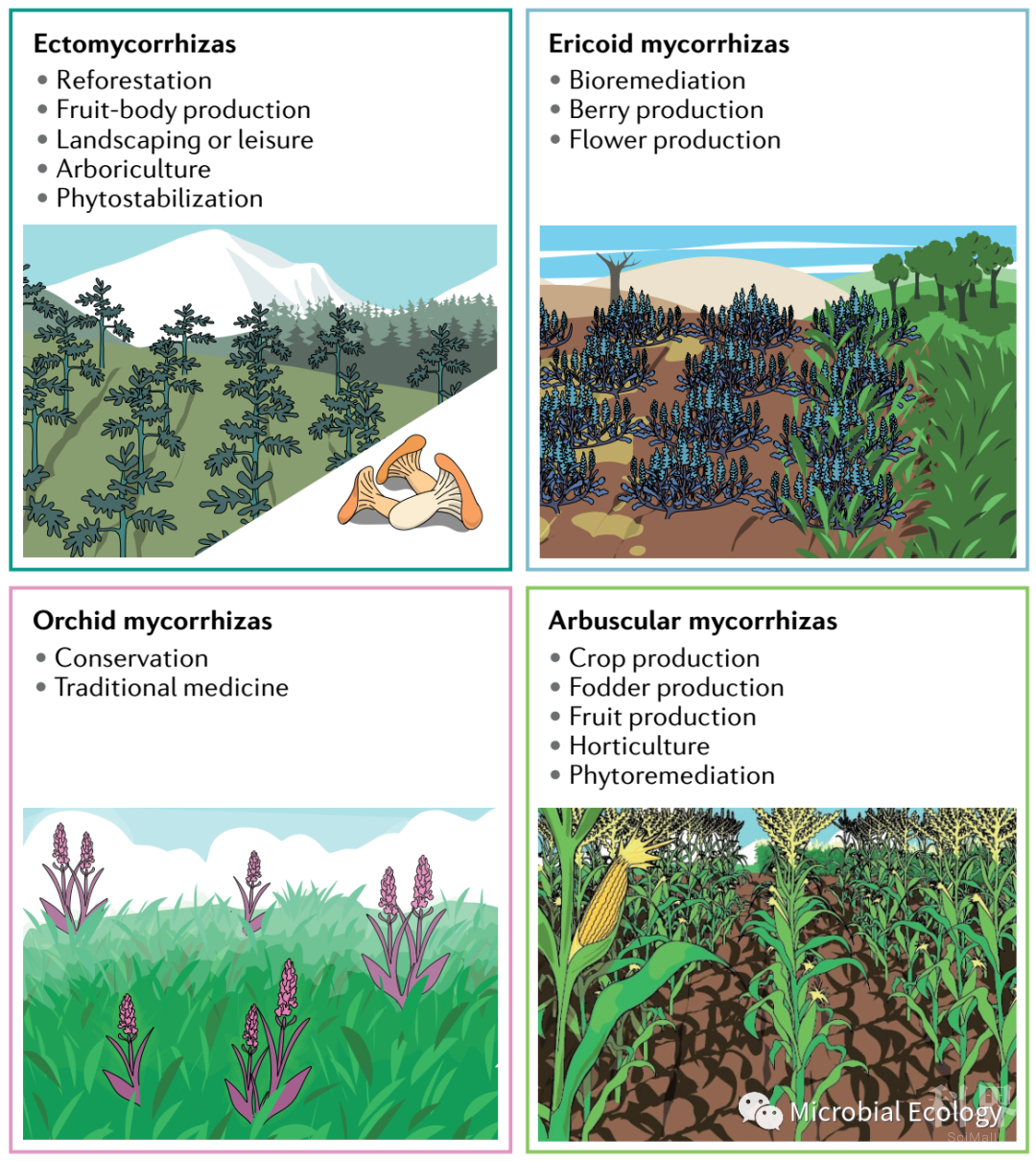
对食品安全和低影响、可持续的农业做法的迫切需求为菌根相互作用提供了广泛的应用领域。在这方面,丛枝菌根真菌(AM)具有最强的潜力,因为它们能在大多数作物中定殖,并且对植物生产力和作物质量有积极的影响。然而,AM真菌在大棚中为寄主植物提供的效益,可能不能直接应用于田间。正如最近的整合分析研究所发现的,增产带来的好处往往并不明显,尤其是考虑到谷物时。还值得注意的是,AM真菌还可能有助于生态系统功能,如土壤聚集和减少养分损失。此外,肥料需求的减少直接影响到以肥料为基础的农业做法的盈利能力和环境影响,即使没有净产量的增加。正如以前所提倡的,必须开发新的生产系统,使寄主植物的利益和菌根共生菌和其它有益微生物所提供的生态系统服务得到最大化,以支持可持续农业。
面对这种巨大的潜力,AM真菌在农业生态系统中的应用提出了一些技术挑战。首先,环境变量在很大程度上影响AM170的有益效果。其次,AM真菌的专性生物培养已经成为大规模接种的主要限制。用脂质喂养AM真菌,为大规模试管生产纯接种提供了新的机会。最后,几个世纪以来,植物育种家一直忽视了有益的植物-真菌相互作用的作用,这导致了在施肥土壤中具有高性能的作物品种,但不特别容易被侵染。基于外源Myc因子(如短链壳寡糖)的植物处理可促进AM的建立,最近提出了一种新的方法。具有这种AM真菌信号的田间处理可以促进本地AM真菌和接种AM真菌的根系定植。
尽管每种菌根真菌的应用前景各不相同,但正面临着共同的挑战。必须增加真菌分离株的种质收集,必须优化菌种产量和配方,必须研究自然变异以确定表现最佳的植物-真菌组合。此外,真菌菌群对菌根有益作用的影响远未被完全了解。最后,在发展中国家大规模生产菌根植物的可行性和技术的发展是必须解决的关键方面。
菌根的起源和进化
由于菌根在古代和现存生态系统中的重要性,根据古生物学、基因组和系统基因组的研究数据,已有若干综述中探讨了菌根的进化,以及植物和真菌的多样性,最终目的是破译他们普遍的生态成功的起源。
最早的植物-真菌结合的化石证据是在4.07亿年前的苏格兰莱尼燧石,那里已经灭绝的植物的根状茎,寄生着类似丛枝结构。这些结构与在现存植物根系中观察到的AM相似(框1),提示AM共生在植物最初侵入陆地的过程中发挥了作用。苔类是现存植物中最早分化的类群,AM在现存物种中的出现(图2)支持了这一假设,尽管尚未发现这些非维管植物的菌根化石。苏格兰莱尼燧石标本表明,侵染第一批陆地植物的AM真菌并非只归属于肾小球菌亚门,还发现胞内形态十分接近毛霉亚门的真菌。事实上,系统基因组学证据表明,毛霉菌和肾小球菌(AM)起源于志留纪中后期,大约4.2亿年前(MY A)年。
即使ECM的起源(框1;图1)可能与松科(裸子植物)的出现有关,在170 - 270 百万年前, ECM化石更近,可追溯到52 百万年前,在早始新世时期。倪藤-松假说认为麻黄目是松科的姐妹群体,有趣的是,买麻藤目的成员也有ECM。然而,其它买麻滕成员(它属和麻黄属)是AM植物,就如剩余的裸子植物,包括“活化石”银杏。这些数据表明,只有部分裸子植物失去了原始的AM状态而接受了ECM条件,可能是受到了环境约束的压力。总的来说,AM共生在被子植物中的优势反映了这个谱系自140-180 百万年前的进化爆发以来在生态上的成功。主要的例外是兰科和杜鹃花科,这两个科发展出了不同的菌根相互关系。目前还没有令人信服的ORM化石,但它们的出现必须追随这个家族的晚白垩纪起源。ERM在杜鹃花科中发育,起源于AM祖先,其最古老的化石属于现存的白刺属(木藜芦属),始于66-72百万年前。
尽管化石记录的不连续性,菌根相互作用很可能是在现存植物的非维管祖先中进化而来,并起到辅助作用,有利于植物从严酷的原始土壤中获取养分。从这一点而言,在现存的早期分化植物(苔藓植物)中缺乏菌根相互作用的现象似乎令人费解。在苔藓(包括模型物种小立碗藓)中没有菌根,而在角苔和地本(苔类)中却不规律地发现菌根(图2),其中同属地钱属植物粗裂地钱和地钱分别为菌根和非菌根。最近的一项调查显示,被检测的苔类中与真菌有共生关联关系的不足30%,而与肾小球菌属成员有共生关联的更是少之又少。然而,到目前为止,被研究的物种数量有限。同样,AM真菌在早期分化的管状植物如蕨类和梅花苔藓中也不占优势。解开这一难题的线索可能来自对受AM侵染的苔类植物的观察,即在高二氧化碳条件下,类似古生代时期的大气条件下,这些植物的光合作用和生长促进作用都增强了。因此,人们很容易推测,在较近的地质年代,大气中二氧化碳浓度的逐渐减少过程削弱了AM在这些早期分化植物中的作用。还有一些更明显的生态事项可以加入进来去看待生物圈的进化:尤其是苔藓植物生活在非常潮湿的环境中,与潮湿的土壤表面密切接触,可能减少了对AM真菌作为水和矿物质供应者的需要。相反,种子植物(裸子植物和被子植物)对AM的偏好可能反映了菌根共生对种子品质的积极影响。对玉米和小麦等作物的研究表明,菌根植物种子更大,营养含量更高。仅这一观察结果就表明了一种直接的代际效应,对菌根种子植物的成功具有明显的影响。

图2. 现存苔藓植物丛枝菌根共生关系。a、孢子囊孢子囊的横切面显示,在光合作用的绿色组织下面的中央薄壁组织中有丛枝菌根真菌结构。b、高倍放大显示的详细的分枝形态,大的主干菌丝产生较细的分枝。c 、透射电镜显示,这种细胞内菌丝被内陷的宿主膜包围,产生一个界面室,这是所有内生菌根的一个恒定特征。尺寸条,150条(a部分),15条(b部分)和0.25条(c部分)。虽然追溯AM真菌的祖先不是一项容易的任务,但肾小球菌群的成员与成员富脂但主要腐生的被孢霉和粘菌素。关于潜在腐殖质起源的关键信息将来自最早分化的肾小球菌群的基因组测序,包括土吸菌,一种与光合蓝藻相关联的非AM真菌。
菌根的进化趋势
就它们的进化史而言,菌根真菌是高度多样化的。然而,对大量真菌物种的基因组测序(见真菌基因组资源支原体)表明,趋同进化机制可能塑造了它们的基因组。所有菌根真菌最显著的共同特征是小分子分泌性蛋白家族的扩张,这些蛋白家族可能作为效应物(图3)来操纵宿主反应并促进互利的相互作用。然而,这种基因组特征也存在于其它与植物相互作用的微生物中,如植物病原体,其效应功能已被广泛地表征。此外,有限的植物细胞壁降解碳水化合物活性酶(CAZymes)塑造了最古老的AM和ECM真菌特征。腐生真菌中,植物细胞壁降解酶是降解土壤有机凋落物的重要手段。虽然没有数据支持AM真菌从含有CAZymes的腐生真菌祖先进化而来,但系统基因组重构清楚地显示担子菌门ECM真菌独立于腐生生物进化而来,主要是具有木质素和/或纤维素降解基因的木腐白色和棕色腐真菌。在大多数情况下,ECM的生活方式有利于木质纤维素和土壤有机质中酚类化合物降解的基因损失。然而,单个ECM物种中对腐生性相关基因的保留程度在不同的谱系中是不同的,这可能反映了它们的进化史和特定的生态功能,例如向寄主植物提供有机物衍生氮的能力。盘菌亚门 ECM的基因组测序,如广泛分布的土生空团菌和一些属于块菌科的松露,也揭示了子囊菌群中木质纤维素降解酶的减少。

图3. 菌根真菌互作的特有和共有特征。
无论它们的进化历史如何,在AM和ECM中CAZymes的少量补充表明,真菌在植物组织中的定殖可能在很大程度上受到宿主植物的调节,根据其营养需求和生理状态。值得注意的是,真菌降解植物细胞壁多糖的能力较差,也会限制降解副产物的释放,而降解副产物是植物防御的有效激发剂。
与AM和ECM明显相似的进化趋势相反(图2),在ORM和ERM真菌的基因组中发现了一组惊人的细胞壁降解酶。它们在ORM真菌中的出现与这些真菌在植物营养中的作用一致,如伞菌纲的内生担子菌 Serendipita vermifera (蜡壳耳目)和美孢胶膜菌 (鸡油菌目)。在它们发育的早期阶段,兰花是异养的,ORM真菌给它们提供碳水化合物,这些碳水化合物很可能是从土壤有机质中提取的。除了多糖降解酶,ERM子囊菌成员麦粒肿和杜鹃花根霉的基因组还包含大量的脂肪酶、蛋白酶和次级代谢酶,很像腐菌和非菌根真菌内生菌。总的来说,在系统发育上距离较远的ORM和ERM真菌的基因组特征中,大量的小分子分泌蛋白(可能参与了它们与宿主的相互作用)与一系列细胞壁降解酶相关联(图3),反映了它们双重的生物营养和腐生营养能力。这可能是腐殖生物向菌根生境进化不完全过渡的结果,可能是由于这些共生生物的最近起源,两者都只在被子植物类群中发现。然而,一些ECM血统也起源于最近,并且经历了CAZymes大幅度巨减。例如,分子数据显示,蜡蘑属的ECM真菌谱系起源于约56-66 MYA前,47分化而来,而系统基因组学将ERM真菌的起源定位在118 MYA,与欧石楠科的起源提出时间大致相同。与AM和ECM真菌不同的是,一个更有趣的假设解释了ERM和ORM真菌的基因组特征,该假设来自于对狭窄生态位的专门化通常会导致基因丢失的观察。因此,我们可以假设是(在较小程度上ECM)真菌进化成特有菌根共生体同时丧失特定的基因,而ERM和ORM真菌保留一个更广泛的生态位,这允许他们在腐生环境(土壤)、菌根(根系)甚至致病策略之间切换。
AM真菌的基因组测序为解释它们专性生物营养体的特殊状态和它们的一些特征功能属性提供了线索。不同的AM真菌物种具有相当数量的基因分布在非常大的富含转座因子的基因组上的特征,从非根食菌的125 Mb到玛格丽塔岛的770 Mb不等。吸收磷酸盐是最早期研究阶段发现的AM真菌最具标志性的共生功能,但直至最近G·玛格丽塔的基因组序列才揭示并发展了磷酸代谢相关基因,支持这些真菌生物肥料的关键作用。一些基因组也发生了缺失,所有的AM真菌序列中缺乏一些基本的代谢过程,如脂肪酸和硫胺(也称为维生素B1)的生物合成。脂肪酸合成酶的缺乏激发了最近的发现,AM真菌是——以大量积累储备脂质为特征——脂肪酸营养缺陷体,从宿主植物中获得的脂质。尽管追溯AM真菌的祖先不是一项容易的任务,但肾小球菌群的成员与成员富脂除主要腐生的被孢霉和粘菌素。关于潜在腐生性起源的关键信息将来自最早分化的肾小球菌群的基因组测序,包括土吸菌,一种与光合蓝藻相关联的非AM真菌。
总之,真菌系统基因组学为了解符合化石记录的菌根真菌的进化提供了第一个视角。这些数据确认了肾小球菌属和/或粘菌素是最古老的菌根真菌,并强调生物营养作用是不同进化途径导致的共同属性。
共生的特征
无论菌根真菌的分类学、起源和进化历史如何,寄主植物一直是所有植物互作真菌共同面临的挑战。针对AM植物的研究表明,建立共生需要一组核心基因,而这种植物共生的“工具箱”在植物类群中保存。这种遗传信号包括所谓的共同共生信号通路(CSSP)的成员,即SymRK、CCaMK和CYCLOPS,它们在所有AM寄主物种中都保存下来,同时也是豆科植物和放线菌建立共生固氮所必需的。出乎意料的是,这些基因中有少数出现在轮藻(一种与陆地植物祖先亲缘关系最近的藻类生物)中。藻类中缺乏已知的类菌根的相互作用,这就提出了几个有趣的问题:轮藻中的“共生”基因的功能,以及这组基因在早期植物中被激发出新的功能的过程。这个共生工具箱还包括协调下游植物基因表达的转录因子,这些基因参与特定的共生功能,如磷酸盐转运和脂质合成转运。植物系统基因组学和共生工具箱的功能分析有助于鉴定AM宿主的这种基因层次结构。
真菌共生工具箱似乎遵循了不同的进化轨迹。ECM的转录分析显示,许多真菌的共生基因(即在菌根中上调的基因)局限于单一的真菌物种。事实上,紫百合和双色百合的大多数共生诱导基因没有同源性,它们的差异只有大约20 MYA。同时,通过比较AM种中表达的候选分泌蛋白(有望在植物-真菌相互作用中发挥关键作用),我们发现了谱系特异性蛋白的普遍存在。值得注意的是,这些分泌蛋白的表达甚至在相同的AM物种中也可能不同,这取决于寄主植物。基因组数据还指出,在与AM真菌密切相关的物种的基因库中存在着巨大的差异。尽管这些基因中的大多数还没有被鉴定出来,但这些观察表明,在共生关系中可能发挥作用的谱系际特异性基因在菌根真菌的基因组中已经进化了好几次,即使在相对较短的进化时间内也是如此。因此,共生真菌的独特特征不仅限于CAzymes的收敛性损失——至少对AM和ECM而言是如此——还包括谱系特有功能创新的进化。
除了必要的遗传工具箱,共生伙伴需要在土壤中感知彼此,信号交换是菌根共生发展的一个必要步骤。这种共生前的化学对话已在AM中被更深入地研究,许多分子已被描述为互为活跃的共生信号。寄主植物的根活跃地分泌一种独脚金内酯,可被AM真菌感知,促进孢子萌发、菌丝分枝、核分裂和呼吸代谢。就真菌而言,一些几丁质衍生分子(或Myc因子)已在AM真菌分泌物中被鉴定为触发寄主植物CSSP的生物活性信号。这种Myc因子包括由4或5个N -乙酰氨基葡萄糖残留物组成的壳寡糖和脂壳寡糖,其中脂肪酸链和/或硫酸基团连接在寡糖链上。宿主植物对壳寡糖和脂寡糖的感知激活了植物准备真菌定植的反应,范围从共生支持基因的调控到细胞、器官和生物体的生理、代谢和发育变化。
我们对其它菌根相互作用中共生前特征的认识仍然有限。ERM和ORM中作为共生前信号的分子尚未被识别出来,但通过对一些兰花物种的基因组和ERM物种柳杉林的根转录组的同源性搜索,已经确定了植物CSSP的关键遗传成分。这些发现,再加上兰花白芨的CCaMK基因在CCaMK缺陷的变种莲中恢复AM和根瘤形成的能力,表明CSSP在形成不同菌根类型的植物中具有广泛的保护作用。一些参与早期信号传递的基因,包括独脚金内酯生物合成和分泌的关键基因,存在于天麻基因组的多个拷贝中。天麻是一种非光合作用兰花,其营养获取完全依赖于其ORM真菌。这种情况可能增加天麻与ORM真菌伙伴相互作用的能力,并建立共生关系。
最近在ECM真菌L. bicolor中发现了作为ECM前共生信号的分子,它释放出一种脂壳寡糖混合物,能够激活杨树根中的CSSP。然而,杨树中CSSP的保护可能与它同时寄生AM真菌的能力有关。的确,比较分析超过120个植物基因组和270个转录组证明了一组广泛的基因(不限于CSSP)是保守的所有植物系寄主细胞内共生体-包括AM, ORM和ERM以及固氮共生体—但是在谱系进化过程中已经丢失了好几次寄主细胞外共生体(包括ECM和蓝藻菌群)或那些简单的非共生的(图3)。
综上所述,CSSP正逐渐成为调控菌根内所有相互作用的关键途径。鲜有研究能够提出一个更适合说明CSSP成员发挥的广泛作用。特别是,在植物对有益微生物、线虫、寄生植物、真菌内生菌、致病真菌和机械刺激的反应中,发现L. japonicus CCamK和SymRK及其在其它物种中的同源物发挥了作用。这些观察指出了个别CSSP成员的额外作用,与它们在轮藻基因组中的存在一致,不幸的是,它们的功能还没有被鉴定。
植物-真菌的联系和寄生
在互惠信号传递和识别之后,新生侧根的根尖下区域是植物与真菌接触最常见的部位。该区域广泛的发育可塑性和反应性可能是共生体适应的主要要求。在ORM中,可以设想兰花原球茎的胚后细胞具有更明显的可塑性(框1)。
有趣的是,AM真菌是唯一已知的真菌共生体,能够形成特殊的附着结构—菌足。菌丝尖的这种宽而分枝的扩张对真菌来说是一种巨大的资源投资,并产生与表皮细胞的大接触面。它的发生可能与AM真菌不能通过酶的方式主动刺穿植物细胞壁以及因此需要引起宿主的调节反应有关(包括预穿透装置的装配和在胞足下局部细胞壁的松动)。与ERM和ORM真菌直接穿透表皮细胞壁形成对比的是,ERM和ORM真菌在与植株相互作用时都表达大量的植物细胞壁降解酶,在与植物接触的数小时后侵入表皮细胞。
在ECM中,在表皮细胞间和细胞下广泛的菌丝增殖与植物细胞壁凝聚力的减弱有关。真菌定植产生的非原质体间隙被认为依赖于胞间果胶的化学降解,以及菌丝尖端生长产生的机械压力。值得注意的是,最近在L. bicolor中发现,这一过程被共生诱导的内切葡聚糖酶(LbGH5-CBM1)增强。
在所有情况下,大量的真菌菌丝,或在细胞间,如ECM,或在单个植物细胞的管腔内,如AM、ERM和ORM,被安置在宿主组织内。这意味着植物发育过程中大规模地调整以求与真菌协调生长。以ECM为例,这种调整首先发生在根系分生组织中,它们本应产生一种新的递归二分分枝模式,但当真菌覆盖物包裹它们时停止了该活动ECM真菌定植改变根系生长素信号已被认为对上述根系发育过程产生重要影响,即使仍然缺失一个一致的模型。自最早与共生真菌的相互作用中广泛的根系分枝已经在ERM和AM中被观察到。然而,具有所有菌根内相互作用(AM、ERM和ORM)特征的最显著的发育变化发生在定植细胞内部,伴随着包含被宿主细胞膜填满的细胞壁成分的新组细胞隔室的出现(框1)。
这种情况下出现的一个共同特征是共生真菌菌丝无法直接接触宿主细胞的细胞质,它们被限制在多样地共生界面间的非原质体空间内。这些界面也是养分交换的主要场所,因此代表了所有菌根共生体的功能核心。在AM中,共生界面的产生似乎依赖于CSSP信号,与其它植物共生惊人地相似,如共生固氮和放线菌根茎。在AM、ERM和ORM之间观察到大量的结构相似性,以及在ORM中也发现许多AM诱导基因产生的同源物,暗示了在菌根内相互作用中可能使用类似的信号和发育过程。此外,非原质体空间在植物-微生物相互作用中普遍存在,如从豆科植物-根瘤菌共生物的侵染线到放线菌根相互作用,再到特征不那么明显的细菌和内生菌根的相互联系,以及已有较多研究的生物活体与致病菌的相互作用。在所有这些不同的相互作用中,至少有一部分植物细胞的反应是保守的,但是在建立微生物干预植物生长过程的全球模型之前,还需要进一步的研究。
寄生成功的方法
为了维持这种亲密的功能联系,菌根真菌定殖需要对整个植物代谢进行重新编程。在上千个有表达差异的AM植物基因中被发现广泛的植物基因表达调节,反映了真菌侵染时深层细胞的重组。其中一些基因(如苜蓿磷酸转运蛋白基因MtPT4)已被鉴定为AM特异性基因,目前被用作共生功能的标记物。相比之下,在ECM根系中,基因表达在真菌(高达20%的分析转录本)比在植物(2-5%的转录本)中被更广泛地调控。在同一行上,ECM的发育与共生特异性植物标记基因的表达没有关联。
自从第一次对AM和ECM的转录组研究以来,人们对涉及植物防御的基因特别感兴趣。菌根真菌的细胞壁成分确实可以被宿主植物感知为微生物相关分子模式(MAMPs),并引发植物的免疫反应。在最初形成AM时这种短暂激活的防御反应已经在一些研究中被发现。这种激活被解释为植物引发的一种形式,它有助于所谓的菌根诱导抗性,并提高AM植物对生物营养性和坏死性病原体、线虫、昆虫和病毒的抗性。
在MAMPs中,几丁质相关分子作为植物反应的诱导子发挥着关键作用。尽管这幅图还很不清楚,但这种基于几丁质的信号已经被证明会根据植物几丁质主干的长度触发不同的反应。短链几丁质低聚物(四聚体和五聚体)是迄今为止在所有AM宿主中检测到的CSSP的有效诱导子——在豆科植物中,具有侧取代作用的几丁质低聚物衍生物,如硫酸盐基团和脂质尾也发挥了这一作用。相比之下,较长的分子(如壳聚糖八聚物)可以激活病原体相关的分子模式触发的免疫、丝裂原激活的蛋白激酶信号传导、活性氧物种的释放和防御基因表达。事实上,最近在水稻上的研究表明,相同的LysM受体样激酶OsCERK1,参与了共生或致病性信号感知,可能取决于一组共同受体,区分长链和短链几丁质。一项研究发现了这种情况的一个重要因素,揭示了一种分泌的真菌蛋白(RiSLM)对长链几丁质分子具有很高的亲和力,可以起到隔离和掩蔽此类病原体样分子的作用,从而促进对AM真菌分泌物中共生信号的识别。
植物对ECM真菌的早期反应还包括非特异性、广谱防御,包括在菌丝渗透到根皮层的非原质体空间期间几丁质酶和过氧化物酶活性的增加。这种模式在成熟的ECM中减弱。因此,植物防御反应的短暂诱导似乎在AM和ECM之间共享;在这两种情况下,植物激素信号都被认为起着重要作用。
真菌效应子是调控植物反应的分子机制中的新兴角色,在AM和ECM真菌基因组或转录组中已经鉴定出大量假定的效应子。这些效应子中的一些已经被证明进入宿主细胞并干预基因调控。一项开创性研究提供了将AM真菌蛋白(SP7)转入植物细胞核的第一个证据,在那里通过与一种病原体相关的转录因子的相互作用来抵消植物的免疫应答。另一种AM效应子(RiCRN1)最近也被证明位于植物宿主细胞核中,并且对共生进展和丛枝发育至关重要。关于ECM,L.bicolor MiSSP7效应子被认为通过抑制茉莉酸反应基因来干扰植物免疫。虽然在ERM和ORM 菌根的基因组中发现了一些可能起到效应因子作用的小分子分泌蛋白,但在ERM真菌O. maius中仅发现了一个疏水蛋白样蛋白,但其作用机制尚不清楚。
本文概述了支持菌根建立的植物和真菌策略共同特征(图3)。引人注目的是,其中一些分子工具(如MAMPs和效应子)和过程(模式触发和效应触发免疫)也是致病相互作用中的基础。
尽管每个植物分类单元都有各自的进化史,但菌根状态似乎源于陆地植物共同祖先中已经存在的共同遗传基础。陆地植物与AM真菌的协同进化已由化石报告揭示,并被植物生物学家承认为一个教条,但植物-真菌的协同进化也可以假设为其它更近期的菌根类型。因为许多独立的进化事件,一些裸子植物和被子植物类群,如松科,蔷薇分支,开始建立ECM与真菌相互作用,失去了古老的污水营养的策略——包括木质素腐烂功能—授予宿主细胞生存能力。植物-真菌在ORM中的协同进化可能是由兰花特有的营养策略所决定的。ORM真菌在植物发育的早期(如果不是在众多无叶植物的整个生命周期中)向其提供有机碳,从而保证了这个大型植物家族成员的生态成功尽管ERM植物与数量相对较少的真菌类群相互作用,但在这种共生关系中可能的协同进化并不清楚,因为大多数真菌伙伴具有广泛的生态位。在早期分化的植物,如苔藓和蕨类植物中,菌根共生的频率很低,这仍然是一个谜。古海洋和M. polymorpha似乎是比较“组学”研究的理想系统,以阐明它们对共生真菌的不同态度,而早期分化植物的系统基因组学有望提供更广阔的图景。尽管真菌基因组测序已经确定了关键球员互动,如分泌效应器,AM真菌遗传方法,不幸的是仍然够不着,尽管几个物种菌根子囊菌类和担子菌类的遗传转化,数量有限的功能研究已经发表。
在全球环境变化的背景下,人类活动对菌根的建立和功能的影响尚未得到充分理解。例如,在集约化农业中,高磷酸盐利用率是预期的条件,它抑制了AM的形成,可能影响了早期信号事件。相反,由工业活动造成的土壤污染物可能导致耐重金属真菌的选择,这些真菌可能在其共生性能方面更成功。这些例子表明,作为共生关系发展和功能的主要决定因素,环境条件可能会克服伴侣双方的基因蓝图,并促使进一步的调查。
虽然菌根相互作用发生在高等植物的根中,但通过共生对种子生产和质量的影响,菌根的好处延伸到整个个体,甚至其后代。这种系统效应是众所周知的菌根相互作用中所描述的生长效应的基础:这种系统的植物机制的特征对所有菌根类型的影响,如基于植物激素的、基于微RNA的或基于肽的信号传导,是该领域未来研究的一个关键挑战。我们设想,越来越多的研究基于大数据,实现模型和相关网络一定会提供新的线索和铅的方法新的研究途径(框3)解决生物和生态农业应用在一个变化的环境下菌根的相互作用的复杂性和新策略。
框3. 研究主题和亟待探究的问题
丛枝菌根真菌的起源和分布
系统基因组学已经证明了外生菌根真菌(ECM)的起源和进化趋势,而真菌形成丛枝菌根(AM)的起源尚不清楚。
AM真菌(肾小球菌)是否起源于腐殖质祖先?黏菌与现存植物谱系的相互作用有多普遍?
它们在植物陆生化中扮演什么角色?
可利用的一套化石数据是否代表了全球在陆地上建立菌根辅助植物的过程?
菌根的特征
尽管最近在鉴定不同菌根类型的信号交换的遗传和分子决定因素方面取得了进展,但仍有几个问题悬而未决。
在AM真菌中,哪些基因和调控网络参与了短链壳寡糖和脂壳寡糖的产生?
菌根真菌是否具有与根瘤菌类似的用于脂质寡糖生物合成的特殊酰基转移酶?
基于脂壳寡糖的信号在ECM真菌中有多常见?
它在ECM真菌与失去了共同共生信号通路的植物的相互作用中保守吗?
石兰花菌根(ERM)和兰花菌根(ORM)的伙伴之间交换了什么信号?
ERM和ORM真菌是否产生几丁质相关的Myc因子?
AM真菌中单脚金内酯的感知机制是什么?
其它植物分子是否参与了共生信号传递?
“共生”基因在非菌根植物和/或非菌根相互作用中的功能是什么?
功能共生体
菌根真菌在向寄主植物发出信号后,必须能够在不触发寄主防御反应的情况下在植物组织中定植,从而建立起一种功能性的互惠共生关系。
AM真菌如何利用其有限的碳水化合物活性酶在植物组织中定植?
内菌根真菌如何在进入宿主细胞后缓解植物防御?特别是,在共生过程中,尽管碳水化合物活性酶强烈上调,ERM真菌如何防止触发植物防御?
由于趋同进化,不同菌根系统中效应物的作用机制有相似之处吗?还是特定于血统的功能更突出?
支持植物胁迫反应的系统信号是否保存在不同的菌根类型中?
植物如何根据环境条件(如养分利用率)调整它们对菌根真菌的敏感性?



 微信公众号
微信公众号
 下载app
下载app
 京公网安备 11010202008974号
京公网安备 11010202008974号