来源:奇点网
免疫治疗是目前癌症治疗的一个火爆领域,虽然已经有好几款药物上市,但这个领域可挖掘的还有非常多。
在前不久的《细胞》杂志上[1],德国癌症研究中心和柏林健康研究所的研究人员发表了新的研究成果,他们找到了一个癌症免疫治疗的新潜在靶点——IL4I1,IL4I1是一个代谢酶,由肿瘤产生,分解色氨酸得到的代谢物能够激活芳烃受体(AHR),从而增强肿瘤的侵袭性,还抑制抗肿瘤免疫。因此,IL4I1抑制可能是一种新的免疫治疗途径。
芳烃受体最初被发现是因为介导了二恶英(芳烃类化合物,工业生产和焚烧产生的有害物质)的毒性作用,在近20年内,研究人员发现,AHR参与调解多个生理过程,包括血管生成、造血、药物和脂质代谢、细胞运动和免疫调节。
激活芳烃受体的配体除了可以是来自环境、饮食的外源物质,微生物和细胞代谢的产物也是一大来源,例如色氨酸的代谢产物[2],而人最主要的色氨酸代谢途径就是吲哚胺-2,3-双加氧酶1/2(IDO1/2)和色氨酸-2,3-双加氧酶(TDO2)这两种。
色氨酸(图片来自wiki)
常常关注癌症领域的朋友们对IDO1和TDO2想必是很眼熟的,这两种色氨酸代谢酶都在多种类型的肿瘤中有高表达,分解色氨酸产生犬尿氨酸,与芳烃受体结合,增强癌细胞的运动性,同时也诱导调节性T细胞抑制杀伤性T细胞的增殖和功能,诱导杀伤性T细胞上PD-1的表达,以及杀伤性T细胞的死亡。
因此,IDO1抑制剂就基于这些问题被研发出来了。然而,2019年,首个IDO1抑制剂的III期临床试验宣告失败[3],在失败的经验总结中,虽然研究人员认为有部分原因是没有基于IDO1表达水平对患者进行分层,但也有观点认为与目前对底层机制的认识不足有关。
因此,研究人员假设,芳烃受体可能有其他激活途径,导致了对IDO1抑制剂的抵抗。为了验证这个假设,他们进行了这次研究。
他们分析了来自TCGA数据库的32种不同类型的肿瘤,大部分肿瘤中,IDO1或TDO2高表达的,芳烃受体也处于高水平。通过WGCNA分析(加权基因共表达网络分析,可以将具有相似共表达模式的基因分类到不同模块中),32种肿瘤中有23种,IDO1和TDO2与芳烃受体存在于同一模块,而另外9种则不存在,说明有其他色氨酸代谢酶激活了芳烃受体。
为了搞清楚这个隐藏的“大佬”,研究人员对7种色氨酸代谢酶进行了重复分析,发现IL4I1居然是芳烃受体相关模块中出现率最高的一个,甚至比IDO1和TDO2都要高,也就是说,在多种人类肿瘤中,与芳烃受体活性相关性最强的,是IL4I1。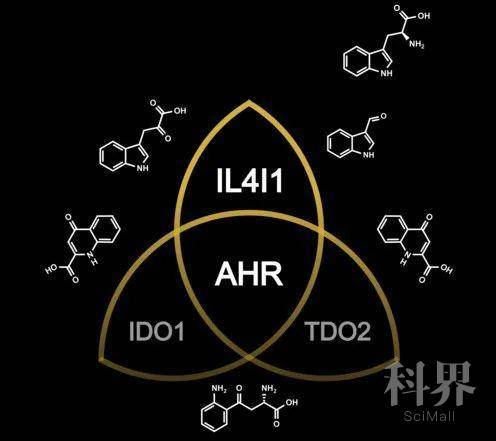
IL4I1、IDO1和TDO2均是可激活芳烃受体的色氨酸代谢酶(图片来自Luis F. Somarribas Patterson)
这让研究人员挺吃惊的,因为在此之前,IL4I1主要被发现是可以催化苯丙氨酸氧化脱氨为苯丙酮酸,还没有发现过它能够在芳烃受体信号通路中发挥作用。于是他们对IL4I1进行了更深入的研究。
在脑胶质瘤细胞模型中,IL4I1的增加提高了芳烃受体的活性和靶基因,包括IDO1和TDO2的转录,反之,IL4I1减少,降低了芳烃受体活性和靶基因的转录。那么IL4I1是通过谁来激活芳烃受体的呢?
和以前的研究一致,在培养过程中,IL4I1会消耗苯丙氨酸、酪氨酸和色氨酸,分别产生苯丙酮酸、羟基苯丙酮酸和吲哚-3-丙酮酸,用它们三个去诱导芳烃受体,研究人员确定了,是吲哚-3-丙酮酸激活了芳烃受体,和犬尿氨酸(就是前面说过的被IDO1和TDO2分解后产生激活芳烃受体的那个)相比,吲哚-3-丙酮酸能够以更低的浓度完成任务。
还是脑胶质瘤细胞模型,吲哚-3-丙酮酸以芳烃受体依赖性的方式,增强了细胞的运动性。激活了杀伤性T细胞中的芳烃受体,并且减少了它们的增殖。
在脑胶质瘤和低度恶性淋巴瘤患者的肿瘤样本中,都检测到了IL4I1的表达,高水平的IL4I1与两种患者的存活率降低均有关。与低水平相比,高水平患者的死亡风险分别增加了2.3倍和3.3倍。
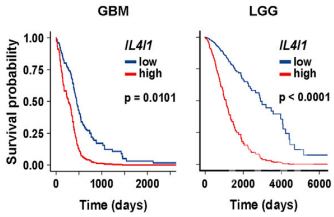
IL4I1低水平(蓝)和高水平(红)的脑胶质瘤(左)和低度恶性淋巴瘤(右)患者生存率对比
除了以上两种肿瘤,在大多数实体瘤患者中,与正常组织相比,肿瘤组织中IL4I1的表达都明显更高,弥漫性大B细胞淋巴瘤是最高的。不但如此,IL4I1的表达基本都要高于IDO1和TDO2,也就是说,IL4I1也是肿瘤中的一个主要的色氨酸代谢酶。
高表达IL4I1的肿瘤表现出一些免疫细胞,如骨髓来源的抑制细胞(MDSC)和调节性T细胞的富集,多组学因素分析表明,IL4I1与多药耐药干细胞和调节性T细胞的存在密切相关。恰巧,MDSC和调节性T细胞的富集也是慢性淋巴细胞白血病的特征,在复发性患者中,IL4I1的表达也与芳烃受体的激活有关。
因此,研究人员在慢性淋巴细胞白血病小鼠模型中进行了实验,再次验证了IL4I1与癌细胞的运动性增加和免疫抑制有关,而抑制IL4I1则改善了杀伤性T细胞的细胞功能。这意味着,IL4I1是一个新的肿瘤代谢检查点。
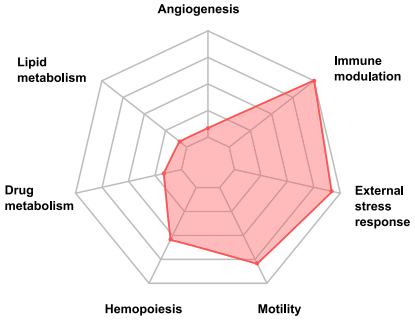
IL4I1激活芳烃受体后的芳烃受体相关模块的特征,最重要的3点:免疫调节、外部压力响应和细胞运动鞋
另外,在一项PD-1单抗nivolumab治疗的晚期黑色素瘤患者试验中,研究人员观察到了IDO1和IL4I1的增加,这个队列中有一部分患者先前接受过ipilimumab治疗,而对于其他未接受过ipilimumab但接受了nivolumab治疗的患者,IL4I1的水平也有显著增加。
虽然之前认为IDO1可能是导致PD-1抑制剂不起效的原因,但IDO1抑制剂与PD-1抑制剂联合治疗的临床试验却失败了,基于这次的研究,研究人员认为,或许IL4I1正是试验失败的原因所在,IDO1抑制剂无法抑制IL4I1的活性。
对于这项研究,通讯作者Christiane Opitz博士表示,IL4I1有成为治疗靶点的巨大潜力,目前,色氨酸代谢酶抑制剂在临床试验中并没有取得好的效果,而IL4I1的作用一直被忽略了,它的临床应用价值值得研究人员去探索[4]。



 微信公众号
微信公众号
 下载app
下载app
 京公网安备 11010202008974号
京公网安备 11010202008974号