来源:X一MOL资讯
选择性破坏蛋白-蛋白相互作用(PPI)以调控生物进程被认为是当今新药开发的重要策略,而多肽药物由于具有模拟蛋白质构象的能力,因此被认为是调控PPI的理想工具。但是,由于多肽药物天生易降解、难穿膜与靶点富集能力不足的问题,靶向细胞内的蛋白相互作用靶点一直是多肽药物开发的难点。
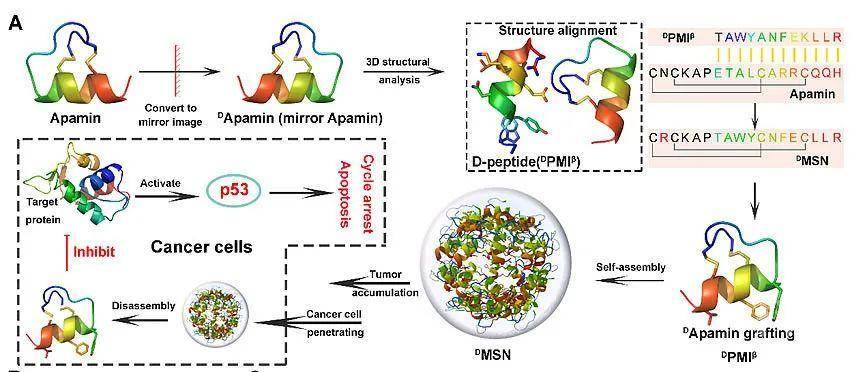
为了给靶向细胞内PPI的多肽药物开发提供新的技术解决方案,西安交通大学第一附属医院何旺骁特聘研究员团队与第二附属医院闫瑾研究员团队基于前期关于多肽药物工程化的研究基础,设计了一种自组装超分子手性嫁接蛋白(图1),不仅能有效实现手性多肽药物的靶向富集与治疗作用,而且降低了多肽药物的免疫源性。该手性嫁接蛋白是将MDM2的D型多肽拮抗剂DPMIβ,通过“镜像匹配”与“表位嫁接”策略,获得手性微蛋白,进一步通过氨基酸突变,构建能够自组装的超分子手性微蛋白。如图2所示,选取蜂毒明肽(Apamin)作为嫁接模板,然后将蜂毒明肽与DPMIβ进行序列与结构的比对,获得嫁接了DPMIβ的新序列,进一步进行氨基酸突变,使得手性嫁接蛋白能够通过亲疏水作用与氢键,自组装成超分子手性蛋白纳米颗粒(DMSN)。DMSN超分子手性蛋白继承了手性多肽/蛋白的先天优势与模板Apamin的阳离子主动穿膜能力,同时具有胞内氧化还原可控的解组装能力,通过调控p53-MDM2/MDMX蛋白相互作用,实现抗肿瘤治疗与协同免疫治疗。
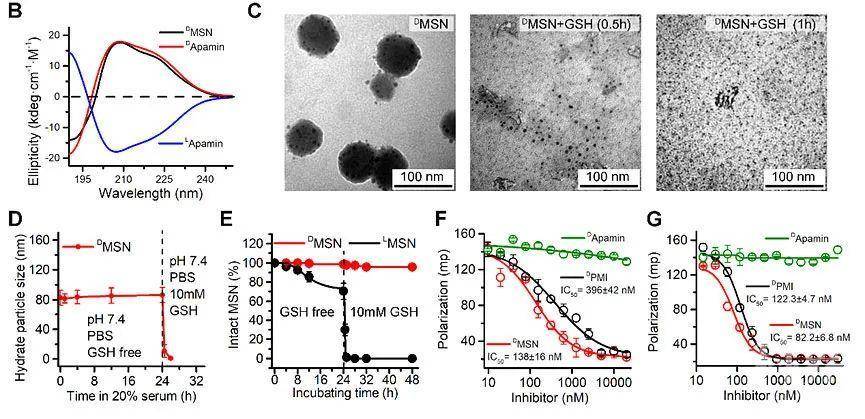
团队首先通过圆二色谱确认嫁接过程的成功进行。然后,通过TEM与DLS,双方面验证了DMSN具有还原性响应的能力。进一步,体外模拟DMSN蛋白水解过程,将DMSN及其相同序列的L-对映体LMSN,分别在含有血清与G组织蛋白酶的培养液中孵育。发现在24h内DMSN可以保持完整性,而相同序列的L-对映异构体中有25%以上被降解。更重要的是,添加GSH后,几乎所有被还原的LMSN均被降解,而90%以上的DMSN还保持完整。表明DMSN具有良好的抵抗酶降解的能力。通过荧光偏振的竞争测定法测量了还原型DMSN单体对靶蛋白MDM2 / MDMX的竞争结合能力,证明 DMSN继承了嫁接肽的生物活性功能(图3)。
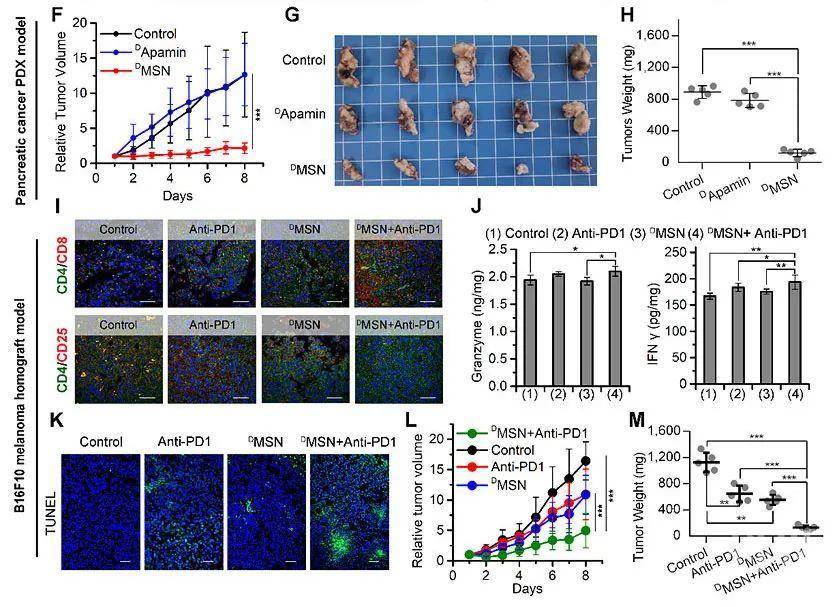
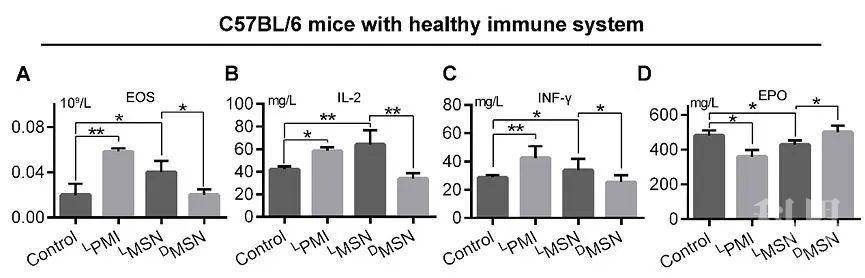
团队进一步利用人源PDX模型与黑色素瘤同种移植模型验证体内药效与协同治疗效果(图4),并考察了DMSN的免疫源性(图5)。综上,这种通过“多肽镜像嫁接”和衍生的自组装策略,构建具有生物活性功能的手性蛋白纳米颗粒,为用于临床预防和治疗人类疾病的研究提供了新策略方法。



 微信公众号
微信公众号
 下载app
下载app
 京公网安备 11010202008974号
京公网安备 11010202008974号