来源:植物科学最前沿
中国科学院遗传与发育生物学研究所储成才课题组于2020年5月20日在Molecular plant 在线发表题为“S-nitrosylation Control of ROS and RNS Homeostasis in Plants: the Switching Function of Catalase”的研究论文,报道总结了S-亚硝基化和反硝基化主要受细胞内活性NO供体S-亚硝基谷胱甘肽(GSNO)的调节,为日后研究ROS和RNS的互作机制提供了新思路

一氧化氮(NO)是一种寿命较短的气体分子,在许多生理和发育过程中起着关键作用。作为亲脂分子,它可以跨越生物膜的所有屏障。NO还能与多种胞内/胞外靶点进行反应,形成一系列活性氮(RNS),比如NO自由基(NO−),亚硝基离子(NO +),过氧亚硝酸盐(ONOO−),S-亚硝基硫醇 (SNOs),氮氧化物(NOx)和二硝基铁络合物等。作为一种信号介质,RNS主要通过蛋白质S-亚硝基化,即在形成S -亚硝基硫醇(SNO)的蛋白质的半胱氨酸硫醇中生成NO部分来实现其生理作用。研究表明,S -亚硝基化和反硝基化的动态过程主要受细胞内S-亚硝基谷胱甘肽(GSNO)水平的调节,而GSNO是生物体中主要的生物活性NO供体。
GSNO被高度保守的GSNO还原酶(GSNOR)不可逆转地降解,GSNO还原酶在拟南芥中由于对 HOT5(与高温有关基因)和PAR2(百草枯抗性有关基因)敏感所熟知。GSNOR1的突变导致细胞内NO和蛋白组SNOs水平显著增加,从而导致具有严重发育缺陷的多效表型,并改变了对生物和非生物应激的反应 (Chen等,2009年; Feechan等,2005年; Lee等,2008年)。所以GSNOR1是细胞内RNS水平的主调节器。
更有趣的是,GSNOR1本身就是S-亚硝基化的靶点。S-亚硝基化可通过改变蛋白构象,稳定性,亚细胞定位,生物化学活性和蛋白质-蛋白质相互作用来调节蛋白的功能。通过自噬相关基因ATG8促进其结合,最终通过自噬降解(Zhan等,2018年)。因此,GSNOR1受植物细胞NO水平正反馈调控。gsnor1-3中GSNOR功能的缺失传递了对氧化应激的抗性,而无供体处理的野生型植株表现出对百草枯的抗性(Chen等,2009年)。这一结果揭示了RNS和ROS之间的联系,活性氧是一类参与各种发育过程的关键信号分子,以及植物的应激反应,包括对过氧化氢、超氧阴离子、羟基自由基和单态氧等的反应。
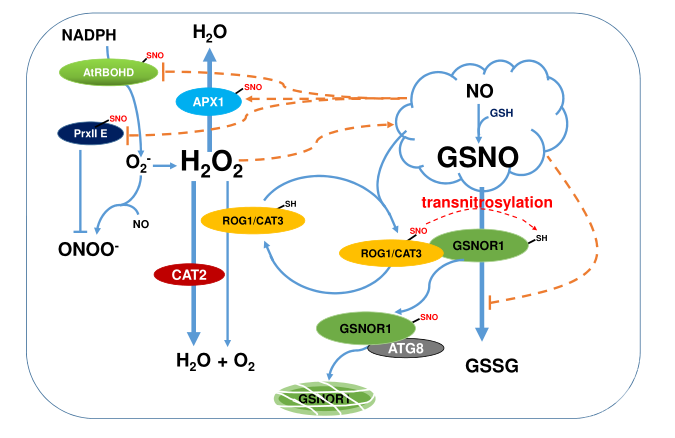
图1.过氧化氢酶的开关功能和转亚硝基化调节ROS / RNS体内平衡
其中蓝色的线表示生物反应,红色的虚线表示亚硝基化过程,橙色的虚线表示分子与蛋白质之间的调节作用。NADPH,烟酰胺腺嘌呤二核苷酸磷酸(还原);AtRBOHD,一种NADPH氧化酶;GSSG,二硫化谷胱甘肽;CAT,过氧化氢酶;ATG8,自噬核心蛋白;APX 1,抗坏血酸盐过氧化物酶;PrxII E,二抗氧化蛋白E;H2O2,过氧化氢;O2 -,超氧阴离子;No,一氧化氮;ONOO -,过氧亚硝酸盐;GSH,谷胱甘肽(还原);O2,氧气。
越来越多的证据表明,S -亚硝基化调节参与ROS稳态的关键酶的活性。例如,NADPH氧化酶的S-亚硝基化导致酶活性降低,导致免疫反应过程中超氧化物的减少(Yun等,2011年)。而抗坏血酸过氧化物酶1 (APX1)的S-亚硝化作用增强了其清除过氧化氢的酶活性,导致抗氧化应激能力增强(Yang等,2015年)。过氧还蛋白(Prx) II E的S-亚硝基化抑制其过氧亚硝酸盐还原酶活性,导致ONOO依赖的硝基酪氨酸残基急剧增加(Romero-Puertas等, 2007)。此外,拟南芥过氧化氢酶CAT2的水稻原体OsCATC发生突变,导致过氧化氢的过度积累,通过激活硝酸还原酶(NR)促进NO的生成,进一步提高SNO水平,导致GADPH和GSNOR1等发生S-亚硝基化(Lin等,2012年)。而且,RNS和ROS分子都是活性氧化还原自由基可以互作形成额外的分子,如过氧亚硝酸盐(ONOO -),通过NO和超氧化物(o2 -)的互作,对不同的生物分子造成不可逆损伤。这些证据建立了RNS和ROS信号通路之间的分子网络,他们的互作在调节应激反应中起着至关重要的作用(图1)。
S-亚硝基化长期以来被认为是一种非酶作用的过程。随着动物和植物中已鉴定的s -亚硝基化蛋白的增加,对s -亚硝基化的选择性提出了质疑。在动物模型和细菌系统中积累的证据表明,一小部分S-亚硝基化的蛋白质可以将NO部分转移到另一个蛋白质上,并使后者硝化,称为转亚硝基化酶(Seth 等,2018年)。但是S-亚硝基化和转亚硝基化机制的选择性在很大程度上仍不清楚,至今还没有在植物中发现过转亚硝基化的特征。
最近,Chen等人报道了拟南芥中第一个植物转亚硝基转移酶的特性(Chen等。2020年)。在gsnor1-3背景下对gsnor1 (rog)突变体的“抑制因子”进行了基因筛选(Feechan等,2005年),鉴定出9个等位突变体。重要的是,gsnor1中升高的SNO水平被rog1 -1突变显著降低,表明在S-亚硝基化需要ROG1。在Chen等人的研究中,他们提出ROG1的作用是作为一种转亚硝基转移酶来调节以一氧化氮为基础的氧化还原信号。ROG1/CAT3的切换功能揭示了ROS与RNS相互作用的托换机制,具有重要意义(图1)。
细胞的生理过程需要一种稳定而平衡的状态,它受亚硝基化酶和反硝基化酶的总活性控制。本文作者提出为了阐明S-亚硝基化在细胞中的作用及其影响,在酶控制的平衡上,SNO蛋白既可作为S-亚硝基化靶点,也可作为转导子。迄今为止,在动物和细菌中只发现了有限数量的转亚硝基化酶。作为第一个被鉴定的植物转亚硝基转移酶,ROG1和ROG1样蛋白在结构上区别于在动物和细菌中鉴定的所有其他转亚硝基转移酶,从而发现了一类特殊的植物转亚硝基转移酶,专门调控植物中的NO信号。然而仍有许多未解之谜,是否已查明ROG1只具有特定的靶点,或者与其他蛋白具有转亚硝基转移酶活性,是否在植物中存在其他具有转亚硝基转移酶活性的蛋白,过氧化氢酶是清除活性氧的重要酶,具有转亚硝基化酶的功能,这是偶然吗?关于ROS和RNS的互作机制的“故事”才刚刚拉开帷幕。







 下载app
下载app